中辦、國辦發(fā)布《關于完善市場準入制度的意見》��,提出優(yōu)化新業(yè)態(tài)新領域市場準入環(huán)境����,選取生物醫(yī)藥等領域,推動重點企業(yè)���、研究機構等創(chuàng)新單元和有關地方建立相關領域全球前沿科學研究協(xié)同模式����,積極參與國際市場準入規(guī)則和標準制定��;最高人民法院發(fā)布《關于審理食品藥品懲罰性賠償糾紛案件適用法律若干問題的解釋》�;國家藥監(jiān)局藥品審評中心就《抗HIV-1感染藥物臨床病毒學研究及數據遞交指導原則(征求意見稿)》公開征求意見……8月19日—8月25日�,醫(yī)藥行業(yè)的這些動態(tài)值得關注。
行業(yè)·政策動態(tài)
1.中辦�、國辦發(fā)布《關于完善市場準入制度的意見》,提出優(yōu)化新業(yè)態(tài)新領域市場準入環(huán)境,選取生物醫(yī)藥等領域����,推動重點企業(yè)、研究機構等創(chuàng)新單元和有關地方建立相關領域全球前沿科學研究協(xié)同模式����,積極參與國際市場準入規(guī)則和標準制定�����,推動重點領域創(chuàng)新成果便捷高效應用�����。
2.最高人民法院發(fā)布《關于審理食品藥品懲罰性賠償糾紛案件適用法律若干問題的解釋》(以下簡稱《解釋》)���。《解釋》共19條����,對保護普通消費者維權、退款和返還食品藥品����、代購人責任、懲罰性賠償責任競合��、生產經營假藥劣藥責任��、懲罰性賠償金基數認定�����、懲治違法索賠等作出規(guī)定��?����!督忉尅纷?月22日起施行�����。
3.國家藥監(jiān)局發(fā)布公告��,參芪十一味顆粒由處方藥轉換為非處方藥���。品種名單及非處方藥說明書范本一并發(fā)布。
4.國家藥監(jiān)局發(fā)布關于恢復進口、銷售和使用UCB Pharma S.A.左乙拉西坦注射用濃溶液的公告�,決定恢復UCB Pharma S.A.自2024年6月4日起生產的左乙拉西坦注射用濃溶液進口、銷售和使用�。
5.CDE就《抗HIV-1感染藥物臨床病毒學研究及數據遞交指導原則(征求意見稿)》公開征求意見���。該指導原則主要適用于HIV-1抗病毒藥物臨床研發(fā)���,提供關于臨床病毒學研究及其資料遞交相關的技術建議。征求意見時限為自發(fā)布之日起1個月����。
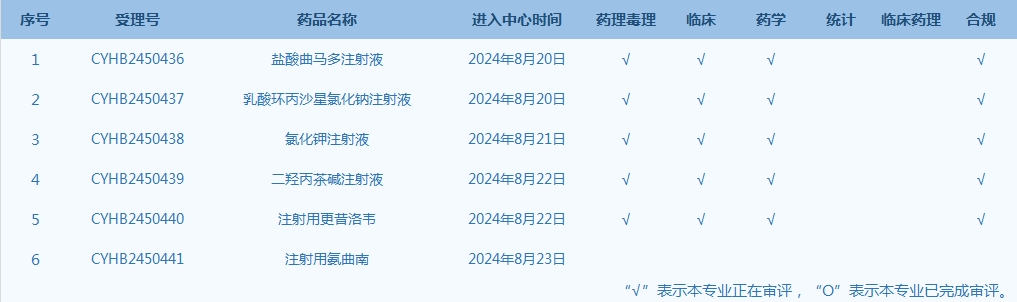
6.CDE網站公示6個仿制藥一致性評價任務,涉及鹽酸曲馬多注射液等品種(截至8月25日)��。
產品研發(fā)·上市信息
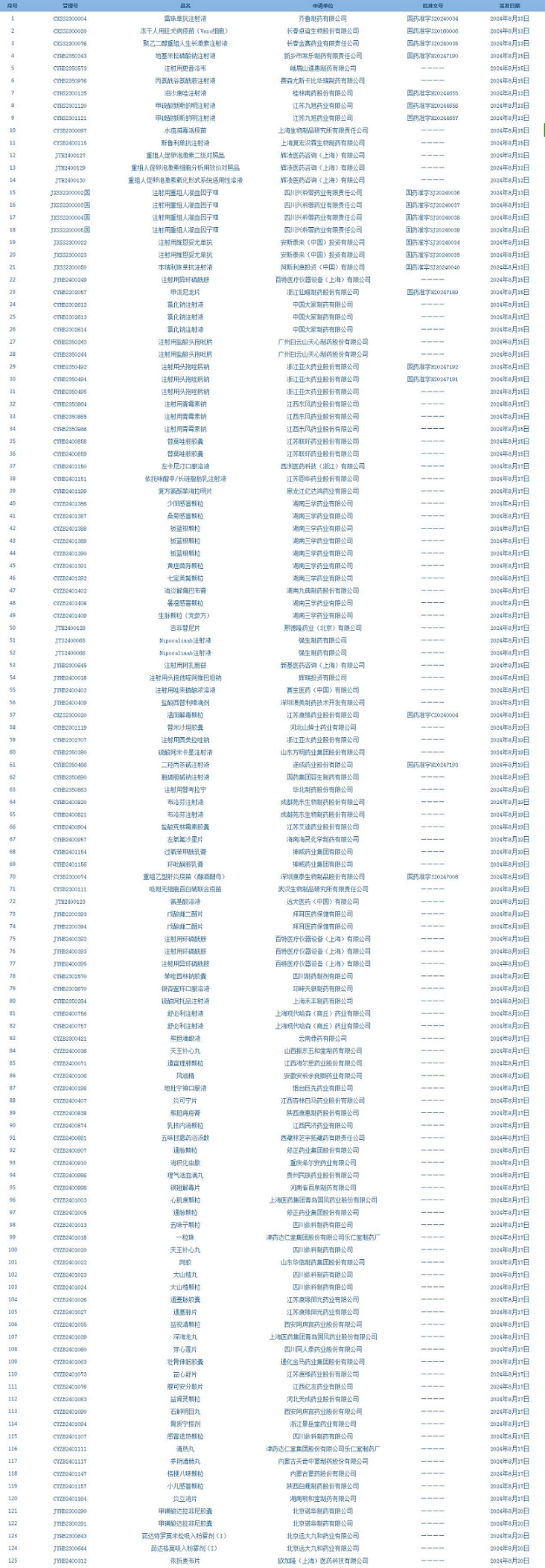
1.國家藥監(jiān)局發(fā)布4期藥品批準證明文件送達信息����,共包括125個受理號����,涉及齊魯制藥有限公司等企業(yè)(截至8月25日)��。
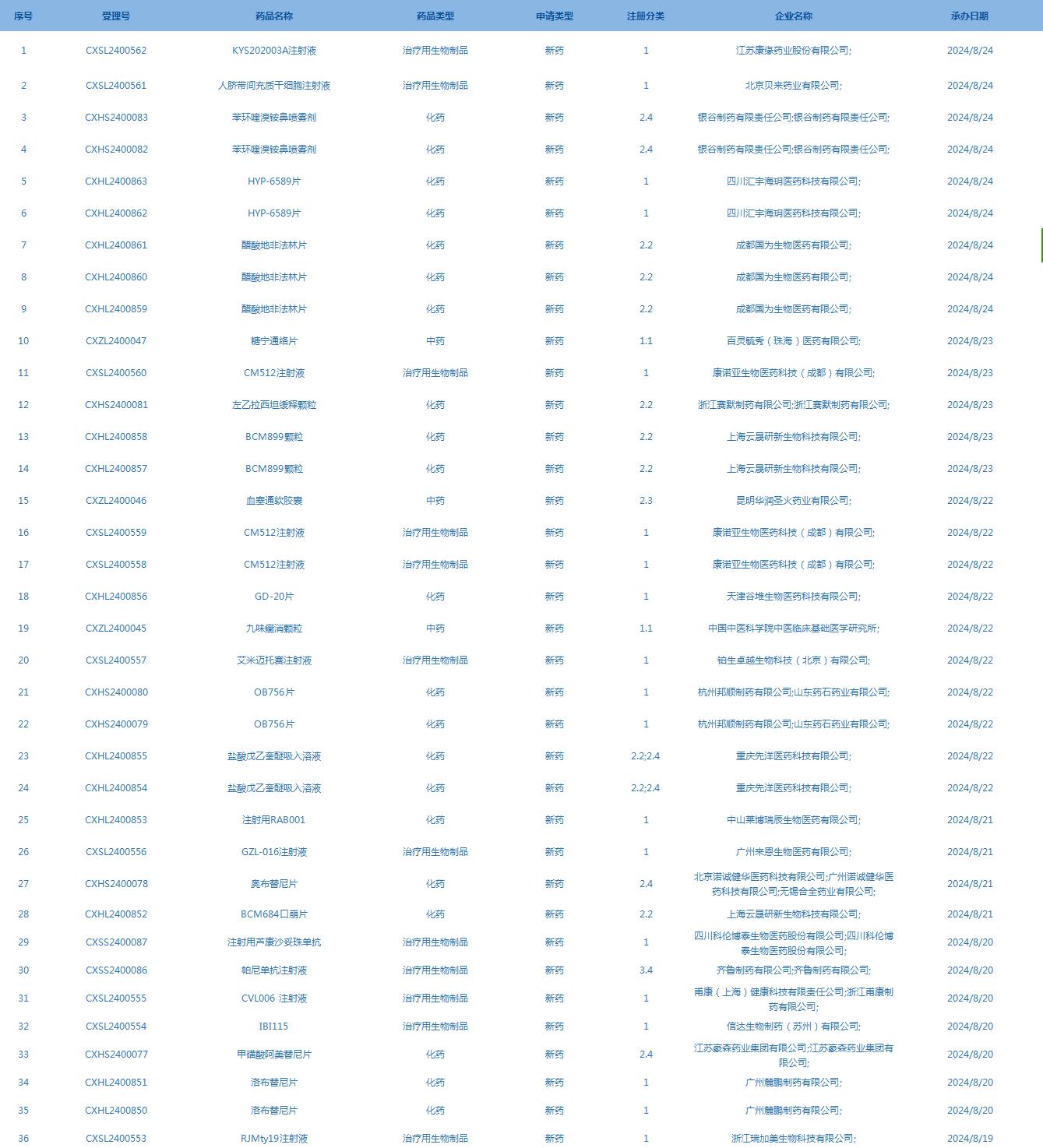
2.CDE承辦受理36個新藥上市申請,包括KYS202003A注射液等(截至8月25日)�����。
3.北京岐黃制藥有限公司提交的雙丹明目膠囊中藥品種保護申請(初保)�����、廣西梧州制藥(集團)股份有限公司提交的注射用血栓通(凍干)中藥品種保護申請(初保)已獲國家藥監(jiān)局受理�����。
4.人福醫(yī)藥發(fā)布公告�,其全資子公司Epic Pharma, LLC(以下簡稱Epic Pharma)的產品熊去氧膽酸片獲得美國食品藥品管理局(FDA)的批準文號��,具備了在美國市場銷售的資格���。
5.一品紅發(fā)布公告�,其參股公司Arthrosi的創(chuàng)新藥AR882獲得美國FDA授予的快速通道資格(Fast Track Designation,FTD)認定�,用于治療臨床痛風患者的可見痛風石���。
醫(yī)藥企業(yè)觀察
1.恒瑞醫(yī)藥發(fā)布半年報�。半年報顯示,2024年上半年恒瑞醫(yī)藥營業(yè)收入為136.01億元�����,比上年同期增長21.78%�����;創(chuàng)新藥收入達66.12億元(含稅����,不含對外許可收入),實現了同比33%的增長�����,成為業(yè)績增長的重要引擎�。
2.石藥集團發(fā)布2024年上半年財報���。石藥集團2024年上半年收入為162.84億元��,較去年同期增加1.3%��;研發(fā)費用為25.42億元��,較去年同期增加10.3%��;目前逾60個重點在研藥物已進入臨床或申報階段�����,其中7個已遞交上市申請����,19個產品(22個適應癥)處于注冊臨床階段���。
3.貝達藥業(yè)發(fā)布關于公司及控股子公司通過美國FDA現場核查的公告。據了解���,貝達藥業(yè)及其控股子公司XcoveryHoldings, Inc(以下簡稱Xcovery)分別于2024年5月����、6月接受了美國食品藥品管理局的臨床BIMO(BioresearchMonitoring��,生物研究監(jiān)測)相關PAI(Pre-Approval Inspection���,批準前檢查)現場核查��、原料藥CMC(Chemical Manufacture and Control�,化學、生產與控制)PAI現場核查��。近日��,貝達藥業(yè)及Xcovery在美國FDA官網查詢到��,貝達藥業(yè)及Xcovery以零缺陷通過了上述現場核查�。
4.科倫藥業(yè)發(fā)布公告稱�����,控股子公司科倫博泰近日收到默沙東書面告知��,默沙東將就SKB571項目行使獨家選擇權��,并向科倫博泰支付3,750萬美元����;待達致特定開發(fā)及銷售里程碑后,將向科倫博泰進一步支付里程碑付款�,并待SKB571商業(yè)化后支付按凈銷售額計算的分級特許權使用費?���?苽惒┨⒈A鬝KB571在中國內地、香港及澳門的開發(fā)��、使用����、制造及商業(yè)化的權利�。據了解,SKB571是一款創(chuàng)新雙抗ADC�����,主要針對肺癌�、消化道腫瘤等多種實體瘤。該產品將于近期遞交IND申請����。
5.同源康醫(yī)藥于8月20日正式在港交所上市。據了解�����,同源康醫(yī)藥是一家臨床階段的生物制藥公司���,致力于發(fā)現����、收購�����、開發(fā)差異化靶向治療方案并對其進行商業(yè)化���,以滿足癌癥治療中亟待滿足的醫(yī)療需求��。自成立以來���,該公司已建立由11款候選藥物組成的管線,包括核心產品TY-9591�����、6款臨床階段產品及4款臨床前階段或早期臨床開發(fā)階段產品���。
6.多瑞醫(yī)藥發(fā)布公告稱�,公司全資子公司湖北多瑞與普德康利簽署技術轉讓合同,湖北多瑞擬以2256萬元自普德康利處受讓氨磺必利注射液60%的產品權益��,普德康利作為該產品的研發(fā)主體保留40%的權益��。本次交易完成后����,湖北多瑞將作為藥品上市許可持有人申報生產���,湖北多瑞和普德康利按6∶4的比例分配該產品銷售收益等相關權益。
藥品集中采購
1.國家醫(yī)保局公布了此前國家藥品集采中的鹽酸溴己新注射液串標案的處置結果�����,成都欣捷高新技術開發(fā)股份有限公司���、仁合益康集團有限公司���、廣州一品紅制藥有限公司等鹽酸溴己新注射液的6家投標企業(yè)被不同程度地暫停參與國采資格,并被列入違規(guī)名單���。
2.江西省醫(yī)保局網站發(fā)布《江西省集采藥品“三進”行動實施方案》,決定在全省范圍開展集采藥品進“零售藥店、民營醫(yī)療機構�����、村衛(wèi)生室”行動��。
3.貴州省公共資源交易網發(fā)布《省醫(yī)保局關于調整2024年第十三批124個藥品掛網交易價格的通知》�����,西安力邦制藥有限公司等81家企業(yè)�����,提交了124個藥品的降價申請���。調整后的價格于2024年8月20日起正式執(zhí)行�����。
4.青海省藥品采購中心發(fā)布關于調整部分藥品價格的通知���,對磷酸西格列汀片等藥品的價格進行調整。(本報記者張可欣整理)
(中國食品藥品網責任編輯:周雨同)